 |
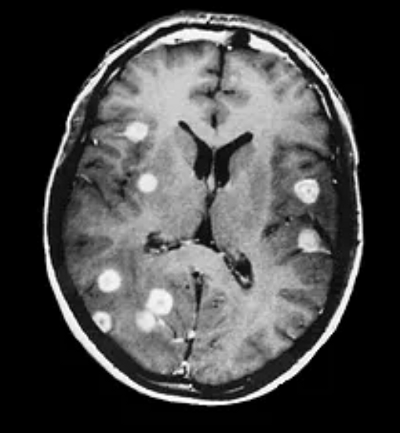
Современные технологии лечения продлевают жизнь онкологическим больным. Это приводит к тому, что пациенты “доживают” до метастазирования в те органы и системы, которые не вполне типичны для данной патологии.
Особенность поражения ЦНС – крайне неблагоприятный прогноз, который вынуждает клиницистов проводить из-за этого ургентные лечебные мероприятия даже при наличии диссеминации процесса и множественном поражении других органов и тканей. Однако своевременное и многокомпонентное лечение с учетом индивидуальных показаний позволяет продлить жизнь больных на многие месяцы и даже годы. При этом особое значение имеют быстрое установление диагноза и выбор тактики воздействия — лучевой и химиотерапии, таргетных средств и ингибиторов ангиогенеза, а также проведение в случае необходимости хирургического вмешательства.
В настоящее время не разработаны стандарты оказания помощи данной категории пациентов, и лечение проводят эмпирически в зависимости от подготовки и индивидуальных особенностей врача.
Для состояния данной категории пациентов характерны нестабильность, высокий риск развития отека головного мозга, особенно в связи с началом лучевой терапии. Это требует превентивного назначения глюкокортикоидов, обычно дексаметазона в дозе 8-36 мг/сут.
При выраженных симптомах назначение по 20 мг и более с последующим снижением до 4 мг 2 раза в сутки сопровождается регрессом неврологической патологии и боли. Однако, несмотря на позитивное влияние в плане купирования неврологических симптомов, выживаемость пациентов и частота ответов на проводимую противоопухолевую терапию не изменяются.
При одной только стероидной терапии продолжительность жизни не превышает 2 мес, лучевая терапия увеличивает ее до 5, а комбинация лучевой и химиотерапии позволяет добиться средней выживаемости порядка 6-9 мес. Средняя продолжительность жизни пациентов с высоким индексом Карновского, отсутствием менингеального и экстракраниального распространения, а также с ограниченным, поддающимся противоопухолевой терапии экстрацеребральным процессом может достигать года и более. Показанием к хирургическому вмешательству служат инфратенториальное поражение с признаками атаксии и солитарные метастазы большого объема (особенно кистозного строения), расположенные в гемисфере. При комбинации лучевой терапии с иссечением метастазов улучшаются показатели длительной выживаемости пациентов, что также наблюдают и в случае использования высокодозного прецизионного облучения (гамма- и кибер-нож). При множественных поражениях и необходимости облучения всего объема головного мозга режимы фракционирования не играют существенной роли.
Основной подход при проведении конвенциональной лучевой терапии по поводу метастазов в головном мозге – облучение всего его объема, обычно в ускоренном режиме, хотя рандомизированные исследования в этом направлении продолжаются. До введения этой высокоэффективной методики лучевой терапии в повседневную клиническую практику на рубеже 50-х годов ХХ в. медиана выживаемости данного контингента пациентов не превышала 1-2 мес. В большинстве ситуаций для профилактики отека в течение первых нескольких суток облучения необходимо назначение дексаметазона по 12-30 мг с последующим резким снижением дозы вдвое.
Используют два боковых противолежащих поля. Особое внимание обращают на адекватность включения в объем воздействия основания черепа и задней черепной ямки. При этом либо экранируют глаза, либо разворачивают поля в соответствии с проекцией основания черепа таким образом, чтобы нижние границы располагались на уровне II шейного позвонка Разовая очаговая доза может составлять от 2,5 до 4-5 Гр, суммарная – 20-35 Гр. Расчет проводят на срединную плоскость. Как правило, наблюдают выраженный регресс метастазов и купирование неврологической симптоматики. При этом в соответствии с рекомендациями МАГАТЭ практикуют увеличение РОД до 4 Гр с точки зрения экономической целесообразности, поскольку режимы фракционирования существенно не влияют на отдаленный прогноз. Следует учитывать, что существенно ускоренное фракционирование, в отличие от традиционного подведения дозы 30 Гр за 10 сеансов, может сопровождаться повышенным риском возникновения новых внутримозговых метастазов ввиду меньшей суммарной физической поглощенной дозы. Однако стандартным подходом в большинстве клиник остается ежедневное облучение всего объема головного мозга в дозе от 3 до 30-33 Гр. Боязнь отдаленных осложнений данного вида лечения часто оказывается гипертрофированной с учетом ожидаемой продолжительности жизни пациентов. Нарушение когнитивных функций у больных при тотальном облучении головного мозга отмечают сразу же после начала лучевой терапии. Это сохраняется после окончания лечения, однако оно ограничено лишь вербальной памятью и не должно служить поводом для отказа от лечения.
Наличие единичных метастазов подразумевает локальную добавку непосредственно на очаги до доз, эквивалентных 50-60 Гр, как правило, в ускоренном режиме фракционирования. При небольшом количестве метастазов (1-3) допустимо локальное конформное гипофракционное облучение (РОД 5-6 Гр, СОД 18-30 Гр). Особое внимание следует уделить одновременной или синхронной химиолучевой терапии. Нарушение проницаемости гематологического барьера ввиду опухолевого роста и/или хирургического вмешательства приводит к быстрому регрессу метастазов при назначении цитостатиков на фоне лучевого лечения. При этом неплохих результатов достигают при использовании препаратов, традиционно применяемых при данных нозологических формах, несмотря на якобы плохое их проникновение через ГЭБ. Активно испытывают в рамках синхронной химиолучевой терапии препараты нитрозомочевины – ломустин, кармустин, фотемустин (мюстофоран). В последние годы обнадеживающие результаты получены при использовании темозоломида (темодала), который изначально предназначался для лечения злокачественных глиом.
В случае стереотаксического лучевого воздействия проводят однократное облучение метастазов в дозе 20-30 Гр. Показания к этому методу – ограниченное количество депозитов (не более 5-10), максимальный их размер не более 3-4 см, отсутствие выраженного масс-эффекта и окклюзионной гидроцефалии. В определенном смысле стереотаксическое облучение конкурирует с оперативным вмешательством при комбинации этих методик с тотальным облучением головного мозга. Наилучших результатов при стереотаксической радиохирургии добиваются в случае небольших очагов, чей диаметр не превышает 1,5-2 см. При этом увеличение отступов от края опухоли свыше 1 мм не ведет к повышению эффективности облучения. Подобную тактику можно использовать даже при увеличении числа метастазов и их локализации в жизненно важных зонах – стволе головного мозга и кавернозном синусе. Медиана выживаемости при облучении на гамма-ноже варьирует от 5-6 мес при метастазах меланомы до года и более в случае почечно-клеточного рака. Очаговое поражение головного мозга без первично выявленной опухоли сопровождается наихудшими результатами лечения, выживаемость не превышает 3 мес. Однако при отсутствии экстракраниальных метастазов и проведении системной химиотерапии иногда добиваются приемлемых показателей. В некоторых центрах хирургическое удаление метастазов сопровождается установкой в послеоперационную полость системы с радиоактивным йодом-125 (GliaSite) или губки с химиопрепаратами (нитрозомочевиной, антрациклинами). При этом весьма перспективной представляют комбинацию данных методик с тотальным облучением головного мозга. Дополнение облучения всего объема головного мозга стереотаксической радиохирургией и/или операцией позволяет увеличить медиану выживаемости в 1,5-2 раза. Однако исследователи не прекращают споры о целесообразности комбинации послеоперационного стереотаксического облучения с тотальным воздействием на головной мозг. Комбинация стереотаксического и тотального облучения головного мозга не очень влияет на выживаемость пациентов по сравнению с одним лишь локальным воздействием, однако частота обнаружения новых очагов снижается примерно в 1,5 раза. Тотальное облучение головного мозга – адекватный метод как самостоятельного лечения метастатического поражения ЦНС, так и в комбинации со стереотаксическим облучением. Оно в первую очередь показано при множественных очагах поражения и неудовлетворительном общем состоянии больного. В случае резекции одиночных метастазов или радиохирургического вмешательства тотальное краниальное облучение служит разумным дополнением в большинстве клинических ситуаций.
При прогрессировании процесса и появлении новых метастазов в головном мозге возможно его повторное тотальное облучение. Показаниями служат хорошая эффективность и переносимость первого курса, срок не менее 6 месяцев после предыдущего лучевого воздействия и удовлетворительное общее состояние больного. При повторном облучении частота полных и частичных ответов может достигать 70%. Некоторые авторы призывают к более широкому применению в этих случаях стереотаксической радиохирургии.
Облучение пациентов с метастатическим поражением спинного мозга и/или позвоночника с переходом на нервные структуры осуществляют по тем же принципам. Обычно применяют заднее прямое вертебральное поле или два паравертебральных под углами с захватом поперечных отростков позвонков и отступами от границ поражения в краниокаудальном направлении порядка 2 см. Лучевую терапию проводят в ускоренном режиме – 3 Гр×10 раз, 4-5 Гр×4-5 раз ежедневно или (в амбулаторном режиме) 2-3 сеанса в 1 неделю. Так как разработаны экономически оправданные режимы фракционирования при метастазах в кости, отчетливо прослеживают тенденцию к однократному облучению спинного мозга в разовой поглощенной дозе 8 Гр. При этом его эффективность по критерию купирования и предупреждения болевого и неврологических (компрессия спинного мозга) синдромов не отличается от фракционированного. В случае необходимости возможно повторное воздействие. Изменение тактики лечения данного неблагоприятного контингента пациентов с использованием комбинации методов привело к увеличению средней продолжительности жизни до 1,5-2 лет и более при относительно торпидном течении основного заболевания. В настоящее время врачи общей лечебной практики должны рассматривать больных с метастатическим поражением головного мозга как подлежащих активному лечению, а не только симптоматической медикаментозной лучевой терапии.
